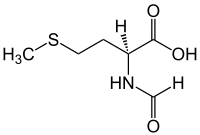
N-ホルミルメチオニン
| N-ホルミルメチオニン | |
|---|---|
| |
(S)-2-Formylamino-4-methylsulfanylbutanoic acid | |
別称 2-Formylamino-4-methylsulfanyl-butyric acid; Formylmethionine; N-Formyl(methyl)homocysteine | |
| 識別情報 | |
| 略称 | fMet |
| CAS登録番号 | 4289-98-9 |
| PubChem | 911 |
| EC番号 | 224-322-8 |
| |
| 特性 | |
| 化学式 | C6H11NO3S |
| モル質量 | 177.22 g mol−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
N-ホルミルメチオニン(N-formylmethionine、fMet)は、アミノ基にホルミル基が付加したメチオニンの誘導体である。細菌やオルガネラDNAからのタンパク質合成の開始に用いられ、翻訳後修飾で除去される場合もある。
fMetは、細菌、ミトコンドリア、葉緑体のタンパク質合成において重要な役割を果たすが、真核生物の細胞質や古細菌では用いられない。ヒトの体内では、fMetは異物もしくは損傷を受けた細胞から放出されるアラームシグナルとして免疫系に認識され、感染の可能性に対して戦うよう体を刺激する。
タンパク質合成における機能[編集]
fMetは細菌のタンパク質合成の開始残基であり、伸長するポリペプチド鎖のN末端に位置する。fMetは、mRNA上の開始コドン5'-AUG-3'と対合するアンチコドン3'-UAC-5'を持つ、専用のtRNA(tRNAfMet)によって、リボソーム(30S)-mRNA複合体へ運ばれる。
fMetはメチオニンと同じAUGコドンによってコードされるが、AUGが開始コドンとして利用される場合にはメチオニンの代わりにfMetが使われ、ペプチド鎖の最初のアミノ酸となる。その後mRNA上に再び出現したAUGコドンには、通常のメチオニンが使われる。この基本的機構は、多くの生物に利用されている。
メチオニンへのホルミル基の付加は、メチオニルtRNAホルミルトランスフェラーゼによって触媒される。この修飾は、アミノアシルtRNA合成酵素によってメチオニンがtRNAfMetにロードされた後に行われる。
メチオニンは、tRNAfMetとtRNAMetの両方にロードされるが、トランスホルミラーゼは、メチオニンがtRNAfMetにロードされている場合にのみ、メチオニンにホルミル基を付加する。
このN末端のfMetは、宿主タンパク質と組換えタンパク質のいずれにおいても、大部分のタンパク質では連続的な2つの酵素反応によって除去される。まず、ペプチドデホルミラーゼがfMetを通常のメチオニンに脱ホルミル化する。続いて、メチオニンアミノペプチダーゼがN末端のメチオニンを除去する[1]。
ヒトを含む真核生物のミトコンドリアや、植物細胞の葉緑体でも、タンパク質合成はfMetから開始される。ミトコンドリアと葉緑体が細菌と共通してfMetによるタンパク質合成開始を行うことは、細胞内共生説の証拠として引用される[2]。
免疫との関連[編集]
fMetは原核生物の産生するタンパク質には含まれるが真核生物のタンパク質には含まれない(細菌に由来するオルガネラによるものは除く)ため、免疫系による自己・非自己の認識に利用される。顆粒球はfMetで始まるタンパク質に結合することができ、これを血液循環中の白血球の誘引の開始に利用し、食作用などの殺菌活性を促進する[3][4][5]。
fMetはミトコンドリアや葉緑体が産生するタンパク質にも存在するため、より近年の仮説では免疫系が自己・非自己の認識に用いる分子とはみなされていない[6]。代わりに、免疫のデンジャーモデルでは、fMetを含むオリゴペプチドやタンパク質は損傷した細菌と同様に損傷した組織のミトコンドリアから放出され、アラームシグナルとなるとされる。fMetを含む典型的なオリゴペプチドであるfMLPは、白血球などの細胞種に存在するFPR1、FPR2Gタンパク質共役型受容体に結合して活性化を行う。これらの受容体を介して作用することで、fMetを含むオリゴペプチドやタンパク質は自然免疫系の一部をなす。これらは急性炎症応答を開始する機能を持つが、他の条件下ではこうした応答を阻害し解消する機能を果たす。
出典[編集]
- ^ Sherman F, Stewart JW, Tsunasawa S (July 1985). “Methionine or not methionine at the beginning of a protein”. BioEssays : News and Reviews in Molecular, Cellular and Developmental Biology 3 (1): 27?31. doi:10.1002/bies.950030108. PMID 3024631.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth edition ed.). New York, NY. p. 800. ISBN 978-0-8153-4432-2. OCLC 887605755
- ^ “Steps Involved in Phagocytosis”. ジョージア医科大学. 2006年9月4日時点のオリジナルよりアーカイブ。2014年11月22日閲覧。
- ^ “The Innate Immune System: Pattern-Recognition Receptors, Antigen-Nonspecific Antimicrobial Body Molecules, and Cytokines”. 2014年11月20日閲覧。
- ^ Detmers PA, Wright SD, Olsen E, Kimball B, Cohn ZA (September 1987). “Aggregation of complement receptors on human neutrophils in the absence of ligand”. The Journal of Cell Biology 105 (3): 1137?45. PMC 2114803. PMID 2958480.
- ^ Zhang, Qin; Raoof, Mustafa; Chen, Yu; Sumi, Yuka; Sursal, Tolga; Junger, Wolfgang; Brohi, Karim; Itagaki, Kiyoshi et al. (2010-03-04). “Circulating mitochondrial DAMPs cause inflammatory responses to injury”. Nature 464 (7285): 104–107. doi:10.1038/nature08780. ISSN 1476-4687. PMC 2843437. PMID 20203610.
外部リンク[編集]
- N-Formylmethionine - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
